Anahid nos muestra una excelente sesión de estadística, donde trataron el tema del error estándar.…
Calorimetría
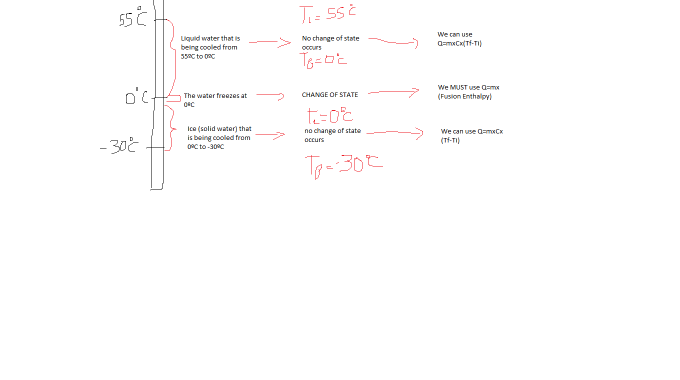
Generalmente los alumnos tienen ciertas dudas cuando se les presentan problemas del estilo » ¿Cuánto calor se intercambia para llevar agua de 55ºC a -30 ºC?».
Por esto,siempre es útil preguntarle al alumno que detalle todo lo que pasa cuando se enfría el agua. Un dibujo es muy útil. El alumno dirá que se enfría al agua hasta los 0ºC en donde se congelará y luego llegará a -30ºC, lo cual es exactamente lo que sucede. En este punto se pregunta al alumno si conoce alguna forma de calcular la energía/calor para estos ejercicios, y cuándo se pueden utilizar tales fórmulas. Entonces se tendrán 2 fórmulas : Q= m*c*(Tf-Ti) y Q=m*(entalpía de reacción). Ambas se pueden deducir; la primera por el concepto de calor especifico, la segunda por el concepto de entalpía. Se debe hacer comprender que la primera fórmula solo se debe utilizar en el instante en que NO hay cambios de estado occuriendo, mientras que la segunda representa el calor intercambiado en un proceso (como puede ser cambio de fase). Entonces, al recordar lo que el alumno dijo inicialmente sobre qué pasa durante el enfriamiento, se puede relacionar cada parte con una ecuación de calor. Entonces el calor intercambiado será la suma de los tres calores. También cabe destacar que muchos errores cometidos por los alumnos son confundirse qué entalpía utilizar, y utilizar 1 calor específico en todo el proceso, cuando se les dan varios. Por esto, hay que lograr que el alumno entienda, que el agua se está CONGELANDO, por eso usamos la entalpía de FUSIÓN del agua. Y como el calor específico cambia según el estado de la materia, hay que usar el del líquido, cuando es agua, y el del sólido, cuando es hielo.
Recordemos que debemos guiar al alumno a que aprenda, por eso deberíamos hacer algunas preguntas «tramposas» para asegurarnos que haya entendido. Y siempre alentarlo a seguir trabajando.
Colaborador: Oscar Mozzino, Tutor Argentino de Química